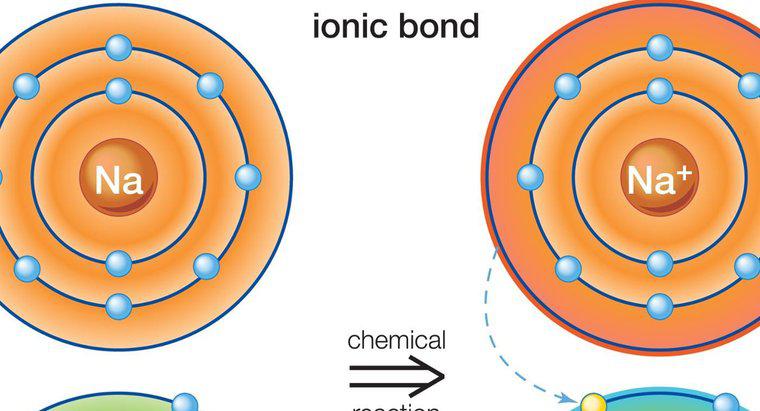
Les composés ioniques sont solides, possèdent des points de fusion élevés, conduisent l'électricité, sont durs mais cassants et sont formés à partir d'une liaison ionique entre un métal et un non-métal. Une liaison ionique est une liaison entre deux éléments avec des charges opposées. Les charges opposées s'attirent, créant une forte liaison chimique.
Les composés ioniques se dissolvent facilement dans les solvants polaires, tels que l'eau. Ils ne se dissolvent pas facilement dans les solvants non polaires, qui comprennent l'éther et l'essence. En effet, les composés ioniques ont tendance à former des molécules polaires, qui se dissolvent dans des solutions de polarité similaire. Un solvant non polaire ne fournit pas assez d'énergie pour rompre la liaison ionique et dissoudre la structure cristalline du composé.
Les propriétés conductrices des composés ioniques s'appliquent lorsqu'ils sont dissous dans une solution ionique ou lorsqu'ils sont fondus. Lorsque les composés ioniques sont solides, ce sont des isolants électriques plutôt que des conducteurs. En effet, les charges électriques ne peuvent pas traverser la structure en treillis serré d'un composé ionique à l'état solide.
Chlorure de sodium, également connu sous le nom de sel de table ; le chlorure de potassium, qui est utilisé en médecine et comme substitut du sel ; et le corindon, le minéral dont sont composés les rubis et les saphirs, sont des composés ioniques bien connus. Tous ces composés forment des structures cristallines, un autre trait commun des composés ioniques.