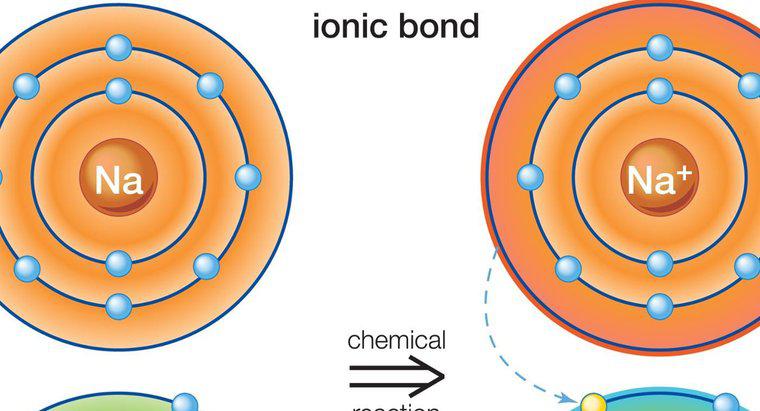
La liaison ionique implique un métal et un non-métal. En effet, la liaison ionique implique le transfert d'électrons de valence. La liaison résultante crée deux ions de charges opposées.
La liaison ionique se produit entre les métaux et les non-métaux car les métaux ont peu d'électrons dans l'anneau le plus externe. Cela rend les métaux plus prêts à perdre des électrons, car cela conduira l'ion à obtenir une configuration stable. Certains non-métaux ont près de huit électrons et nécessitent plus d'électrons pour obtenir une configuration de gaz noble.
Plus d'un électron peut être partagé entre les éléments. Lorsqu'un élément gagne et qu'un autre perd, un élément se charge positivement et l'autre négativement. Que l'élément devienne positif ou négatif dépend s'il a perdu ou gagné des électrons. Une perte entraînera une charge positive, tandis qu'un électron supplémentaire entraînera une charge négative. La charge nette dans le composé doit être nulle. Comme c'est toujours le métal qui donne des électrons, l'élément métallique est positif et l'élément non métallique est négatif.
Un exemple de liaison ionique est le composé chlorure de sodium, communément appelé sel de table. Le sodium contient un électron dans son anneau le plus externe, tandis que le chlore en contient sept. Le sodium transfère son électron au chlore et se charge positivement, tandis que le chlore se charge négativement. La charge nette du composé est nulle, car les deux éléments se sont liés.