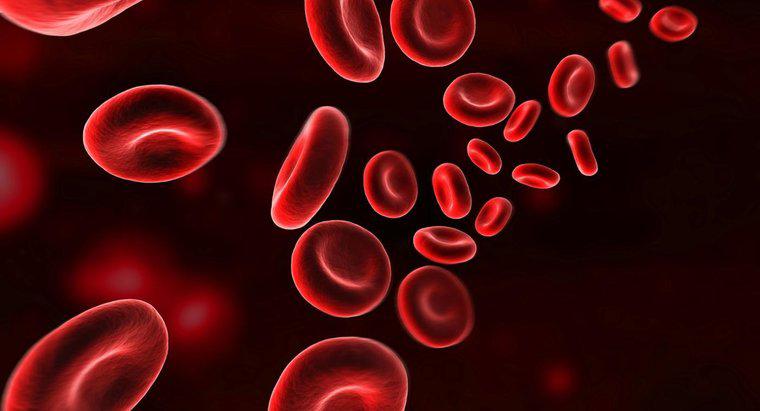
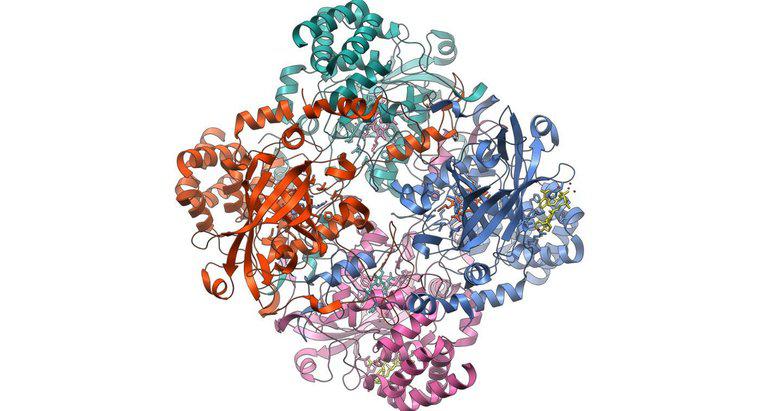
L'hémoglobine se lie à l'oxygène en rouilleant au niveau atomique. La molécule d'hémoglobine dans les globules rouges est ce que l'Office of Science du département de l'Énergie des États-Unis appelle une « métalloprotéine ». C'est-à-dire qu'il s'agit d'une protéine qui incorpore du métal, du fer dans ce cas, dans sa structure. Chaque molécule d'hémoglobine porte quatre atomes de fer liés qui coopèrent pour transporter l'oxygène des poumons, où il est abondant, vers d'autres parties du corps.
Selon le site Web du Centre national d'information sur la biotechnologie, les atomes de fer transportés par l'hémoglobine réagissent à la présence d'oxygène de la même manière que le fer, en se liant à lui dans un processus appelé oxydation. Le composé qui en résulte, l'oxyde de fer, est appelé rouille lorsqu'il se trouve à l'extérieur du corps. À l'intérieur des globules rouges, ces molécules d'hémoglobine oxydées conservent leur cargaison d'oxygène jusqu'à ce qu'elles atteignent une partie du corps qui n'a pas assez d'oxygène, où il est ensuite libéré.
Le même article note que les quatre sous-unités de la molécule d'hémoglobine travaillent ensemble pour lier l'oxygène très efficacement dans les environnements riches en oxygène, mais l'effet s'affaiblit dans les environnements pauvres en oxygène. Cette réaction inégale rend l'hémoglobine désireuse de se lier à l'oxygène dans les poumons et tout aussi désireuse de s'en séparer en présence d'une cellule avide d'oxygène, après quoi le cycle recommence.