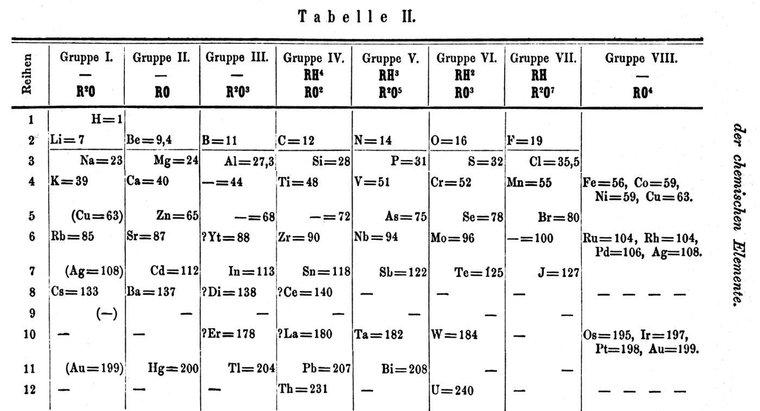
Les gaz rares sont un groupe de sept éléments du tableau périodique des éléments. Ensemble, ils forment le groupe 18 sur la table et comprennent (en nombre atomique croissant) l'hélium, le néon, l'argon, le krypton, le xénon, le radon et l'élément 118, qui a été temporairement nommé ununoctium. Tous les gaz rares présentent des propriétés similaires dans des conditions standard. Ils sont incolores, insipides, inodores et ininflammables.
On pensait auparavant que les gaz rares étaient incapables de former des liaisons chimiques avec les atomes d'autres éléments. On sait maintenant que c'est possible, et ils forment des composés chimiques. Plus le numéro atomique de l'élément est grand, moins il est abondant dans l'univers. L'hélium, de numéro atomique un, est l'élément le plus abondant des gaz rares et l'élément le plus abondant en général après l'hydrogène. L'atmosphère terrestre contient tous les gaz rares.
À l'exception de l'hélium et du radon, les gaz rares sont extraits de l'air à l'aide d'un processus appelé liquéfaction du gaz et distillation fractionnée. L'hélium est obtenu à partir de gisements de gaz naturel par séparation cryogénique de gaz. Le radon provient de la désintégration radioactive des composés du radium.
Il existe plusieurs applications industrielles de l'utilisation de gaz rares. Les ampoules et les lampes sont toutes deux fabriquées à l'aide de gaz rares. Les éléments ont également des applications médicinales. L'hélium est utilisé pour aider les asthmatiques, tandis que le xénon aide à l'imagerie médicale.