La liaison hydrogène implique les déplacements dipolaires créés par les liaisons polaires et se produit entre les molécules contenant des liaisons polaires. L'hydrogène est spécifiquement impliqué car l'élément a une faible électronégativité pour un non-métal et crée un grand décalage dipolaire suffisamment fort pour attirer d'autres atomes électronégatifs à partir de liaisons polaires dans d'autres molécules.
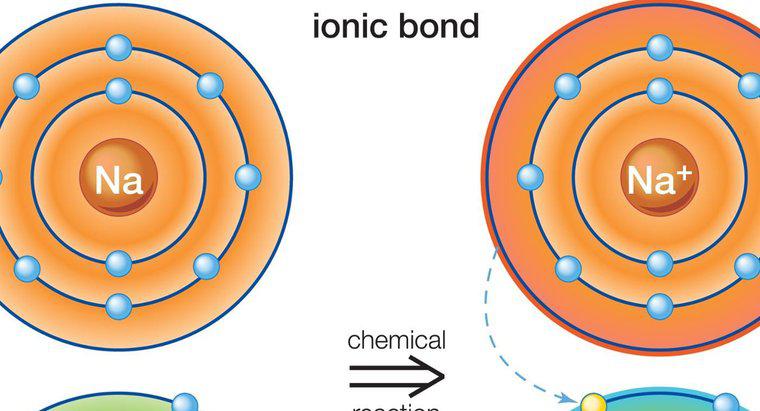
Des liaisons covalentes polaires se forment lorsque les deux atomes de liaison ont une différence d'électronégativité suffisamment importante pour créer un changement de charge, mais inférieure à la différence requise pour former une liaison ionique. Dans une liaison covalente polaire, les atomes partagent les électrons de manière inégale. Cela crée un décalage dipolaire et donne à une extrémité une charge légèrement positive et à l'autre une charge légèrement négative.
Lorsque l'hydrogène est impliqué dans une liaison polaire, il devient légèrement chargé positivement et attire les dipôles chargés négativement d'autres molécules. L'autre molécule n'a pas besoin d'être globalement polaire, mais elle doit avoir des liaisons polaires pour former les dipôles qui attirent ou repoussent les charges d'hydrogène. La liaison hydrogène est une forme de liaison plus faible que les liaisons ioniques ou covalentes, mais elle est suffisamment importante pour créer des propriétés uniques et des forces d'attraction, telles que celles observées entre les molécules d'eau.