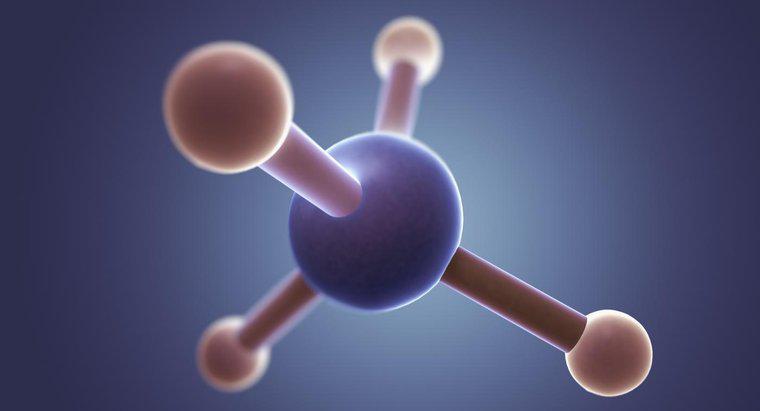
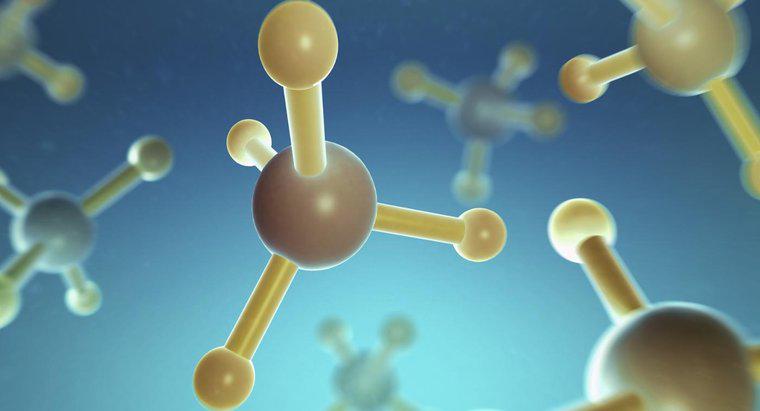
La structure de la molécule de méthane, CH4, présente des liaisons covalentes simples. La liaison covalente implique le partage d'électrons. Dans la molécule de méthane, les quatre atomes d'hydrogène partagent chacun un électron avec l'atome de carbone.
Certaines propriétés des liaisons covalentes sont qu'elles ont tendance à se produire entre deux atomes non métalliques, ont des points d'ébullition et de fusion bas et une faible polarité. A température ambiante, ces molécules covalentes sont soit gazeuses, soit liquides. Par exemple, le méthane est un gaz.
En revanche, les liaisons ioniques ont tendance à être présentes dans les composés solides. Des liaisons ioniques se produisent entre un métal et un non-métal. Certaines caractéristiques des liaisons ioniques dans les composés sont qu'elles présentent des points de fusion et d'ébullition élevés.