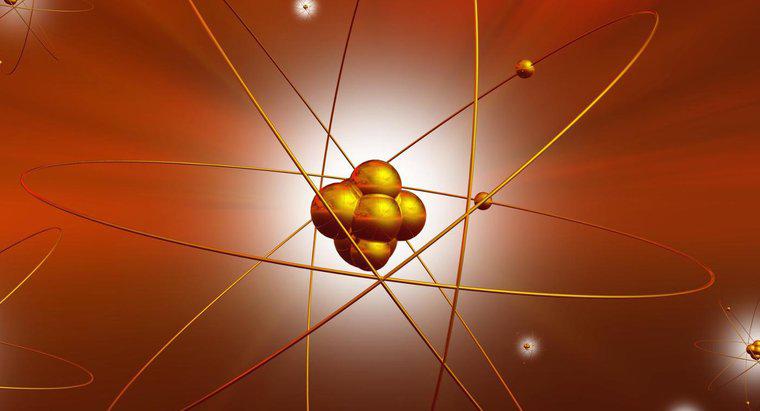
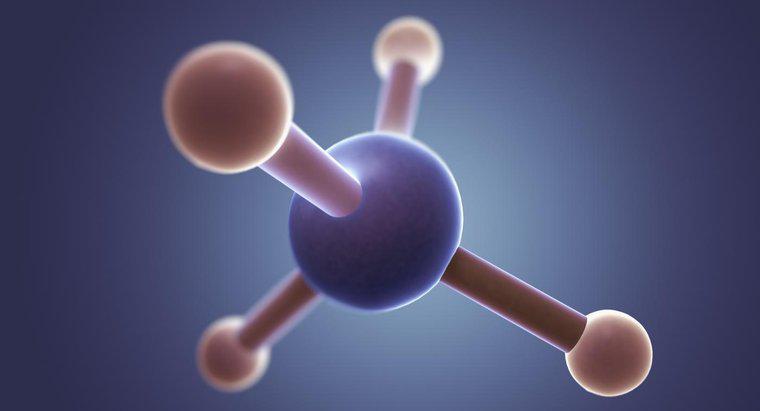
CF4, ou tétrafluorométhane, est une molécule tétraédrique. Comme l'indique la partie « tétra » du nom, la molécule possède quatre groupes d'électrons liés autour d'un atome central.
Comme pour de nombreuses liaisons électroniques, une molécule tétraédrique comporte plusieurs parties. La partie principale de la molécule est l'atome, qui se trouve toujours au centre. Les quatre groupes d'électrons sont espacés autour de l'atome. Ces électrons ne sont jamais en paires isolées, et ils restent toujours ensemble dans un motif régulier autour de l'atome, bien qu'ils ne soient pas toujours à égale distance les uns des autres.
Parce que les électrons sont plus attirés par le fluor que par le carbone, les électrons passent plus de temps plus près du fluor dans le modèle CF4. Les électrons sont maintenus ensemble par des liaisons covalentes, et ces liaisons se rapprochent du fluor et s'éloignent du carbone. Bien que le fluor et le carbone soient quelque peu égaux, le fluor a une force d'attraction plus forte. La formule chimique CF4 reflète la plus grande attraction des électrons vers le fluor. L'absence de nombre avec le carbone indique que les électrons ne sont pas attirés vers le carbone mais en sont plutôt éloignés.