Les atomes impliqués dans la liaison ionique sont maintenus ensemble par une force d'attraction électrostatique entre un ion positif et un ion négatif. Les liaisons ioniques ne se forment qu'entre les métaux et les non-métaux.
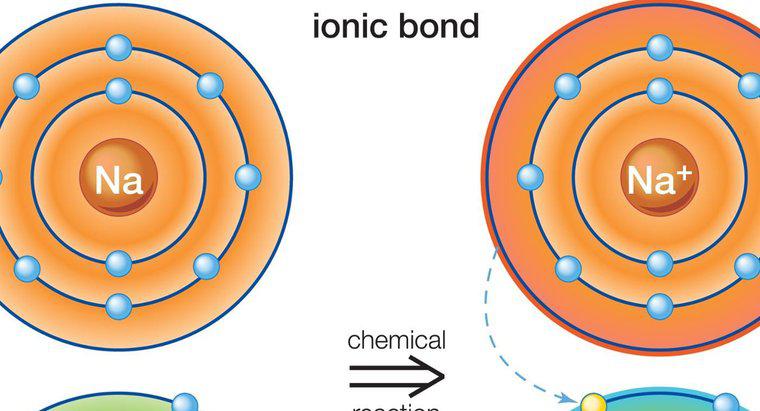
La liaison ionique se produit en présence d'un ion positif et d'un ion négatif. Les ions se forment lorsque des atomes neutres perdent ou gagnent un électron. Tous les atomes perdent ou gagnent des électrons pour obtenir une configuration électronique stable. Les gaz nobles les plus stables ont tous huit électrons dans leur enveloppe la plus externe, à l'exception de l'hélium, qui n'a que deux électrons. Lorsqu'un atome a huit électrons dans sa couche externe, on dit qu'il a une structure d'octet stable.
Les métaux ont un à trois électrons dans leur enveloppe externe, ce qui les empêche de former une structure d'octet stable. Il est plus facile pour les atomes de perdre des électrons pour révéler une couche sous-jacente avec huit électrons, plutôt que de gagner des électrons pour compléter la structure de l'octet. Par conséquent, les métaux forment des ions positifs. Les non-métaux, cependant, ont tendance à gagner un ou plusieurs électrons pour compléter l'octet dans leur enveloppe la plus externe, et ont donc tendance à former des ions négatifs.
Les métaux peuvent faire don de leurs électrons à des non-métaux. Étant donné que les charges sur les ions sont différentes (ions chargés de manière opposée), l'atome de métal chargé positivement est lié à l'atome non métallique chargé négativement avec une forte force d'attraction électrostatique.