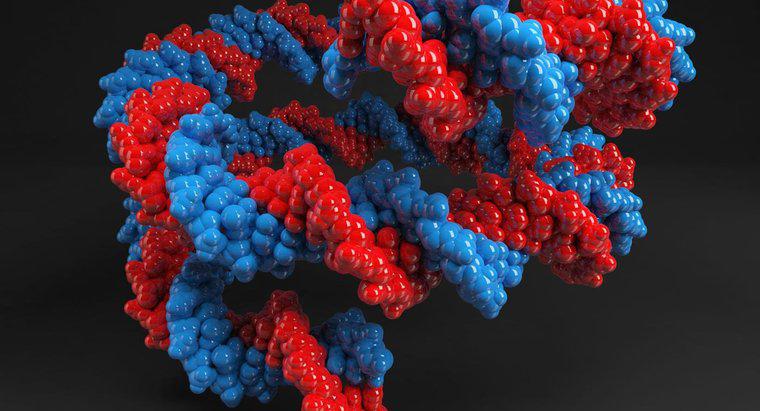
Les protéines ont des structures complexes qui sont dictées par les chaînes latérales de ses acides aminés. La nature des chaînes latérales peut changer lorsque le pH de leur environnement change, ce qui pourrait affecter la structure entière de la protéine et la rendre inactive.
Toutes les enzymes sont des protéines et leur fonction dépend de la structure de l'enzyme. La structure d'une protéine est dictée par trois niveaux. La structure primaire fait référence à la séquence d'acides aminés. La structure secondaire comprend les plis locaux qui forment des hélices alpha ou des feuillets bêta. La structure tertiaire est formée en combinant les structures secondaires. Les structures secondaires et tertiaires sont formées par des liaisons entre les chaînes latérales des acides aminés. Les enzymes ont un site spécifique, appelé site actif, qui se lie au substrat avec lequel elles réagissent pour provoquer un changement physiologique dans la cellule. Si la structure du site actif change, l'enzyme pourrait être inactivée. Changer le pH de l'environnement de l'enzyme pourrait changer la nature des chaînes latérales de l'enzyme et les liaisons qu'elles forment. Cela conduit à une structure différente de celle de la forme active de l'enzyme. La plupart des enzymes et des protéines ont tendance à fonctionner à un pH neutre. Certaines enzymes fonctionnent à un pH plus bas, comme celles trouvées dans l'estomac. Dans de tels cas, changer le pH à un pH neutre les inactive.