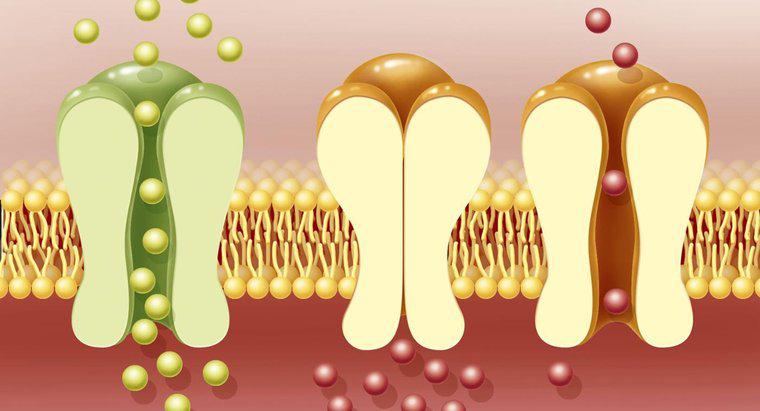
Les deux types de base de cellules électrochimiques sont les cellules galvaniques et les cellules électrolytiques, selon UC Davis. Les cellules galvaniques subissent des réactions chimiques spontanées et libèrent de l'énergie électrique, tandis que les cellules électrolytiques consomment de l'électricité pour alimenter de manière non spontanée réactions chimiques. Les deux types nécessitent une anode, une cathode, des solutions électrolytiques et un pont salin.
Les cellules galvaniques comprennent des appareils tels que des batteries non rechargeables. De tels dispositifs créent un flux d'électrons d'une électrode à l'autre, généralement constitués de deux métaux différents. Dans une cellule galvanique, les électrons circulent de l'anode à la cathode. Au cours de ce processus, l'anode libère des ions métalliques dans une solution liquide ou gélifiée environnante, l'électrolyte. Lorsque les électrons se dirigent vers la cathode, ils sont absorbés par les ions métalliques de la solution qui les entoure, et les ions perdent leur charge et deviennent des atomes métalliques standard.
Les batteries rechargeables agissent comme des cellules électrolytiques lorsqu'elles sont chargées et des cellules galvaniques lorsqu'elles alimentent des appareils, selon UC Davis. Une cellule électrolytique utilise l'électricité pour forcer une réaction chimique à se produire dans la direction opposée à celle qu'elle aurait spontanément. Ainsi, la réaction chimique qui se produit dans une batterie en recharge est l'exact opposé de la réaction qui se produit lorsque la batterie libère de l'énergie.