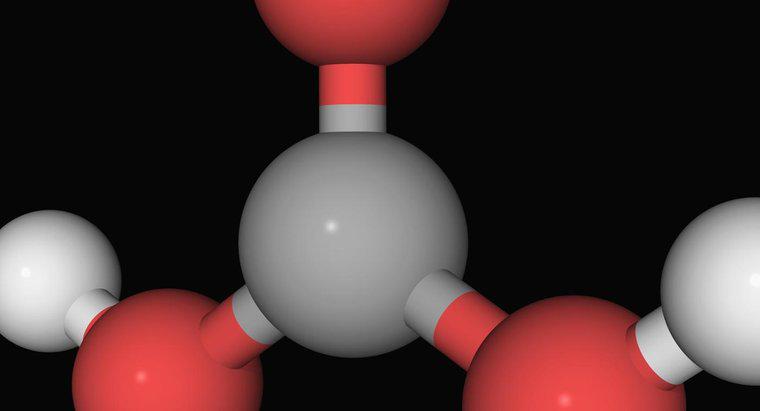
L'équation équilibrée pour la formation d'acide carbonique est CO2 + H2OH2CO2 H+ + HCO3-. L'acide carbonique se forme à partir de la dissolution de l'eau, ou H2O, dans le dioxyde de carbone, ou CO2.
L'acide carbonique, ou H2CO3, est un acide faible qui joue un rôle vital dans la respiration, le maintien de la plage normale de pH dans le sang, le réchauffement climatique , et la carbonatation des boissons. Dans une solution liquide, l'acide carbonique se dissocie facilement en l'ion bicarbonate chargé (HCO3-) et un proton (H+). Une fois que le CO2 se forme au cours des processus métaboliques dans les cellules, il se transforme en bicarbonate, un ion. Cette conversion permet son transport dans le sang dans les poumons, où le bicarbonate se reconvertit en CO2 pour l'expiration.
Chez les mammifères, le même processus se produit avec l'anhydrase carbonique, une enzyme qui peut accélérer la réaction entre la production d'acide carbonique et sa reconversion en dioxyde de carbone et en eau. Le bicarbonate est également utilisé en milieu médical, y compris comme mesure temporaire de réanimation cardio-pulmonaire pour tenter de contrer l'acidose ou l'inversion d'un surdosage en antidépresseurs tricycliques, en raison de sa capacité à tamponner le pH du sang.
S'il y a trop d'acide (H+) dans la solution, l'équilibre se déplace vers la conversion du bicarbonate (HCO3-) en acide carbonique (H2CO 3) qui peut alors former CO2 + H2O. Ce processus diminue la quantité d'acidité dans le sang. Pendant l'hyperventilation, les gens expirent des quantités excessives de CO2, et l'équation se déplace vers la production de CO2 et l'utilisation de l'acide dans le sang, provoquant ainsi une alcalose respiratoire. Ne pas respirer correctement le CO2, comme dans l'apnée obstructive du sommeil, modifie l'équilibre de la production d'acide carbonique et finalement acidifie le sang.