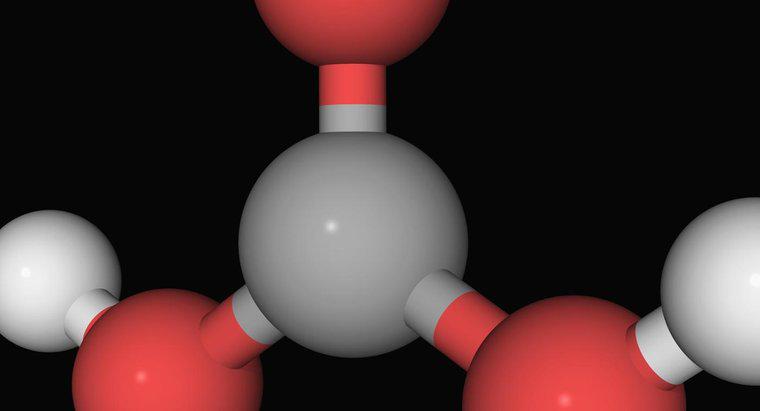
La définition d'Arrhenius d'un acide est un composé qui augmente le nombre d'ions hydrogène chargés positivement, H+, lorsqu'ils sont ajoutés à l'eau. Selon Arrhenius, une base est toute substance qui entraîne une augmentation des ions hydroxyde chargés négativement, OH-, lorsqu'elle est combinée avec de l'eau.
Ces définitions ont été développées en 1884 par Svante Arrhenius, un chimiste suédois.
La définition d'Arrhenius des acides et des bases est l'une des deux définitions régulièrement acceptées. L'autre est la définition de Bronsted-Lowry, qui décrit un acide comme tout composé qui dégage des protons dans une solution aqueuse et une base comme un composé qui accepte des protons supplémentaires.