Lorsque le sodium et le chlore se combinent, le chlore gagne un électron et le sodium perd un électron. En conséquence, le chlore gagne une charge négative et le sodium gagne une charge positive. Ce processus est connu sous le nom de liaison ionique.
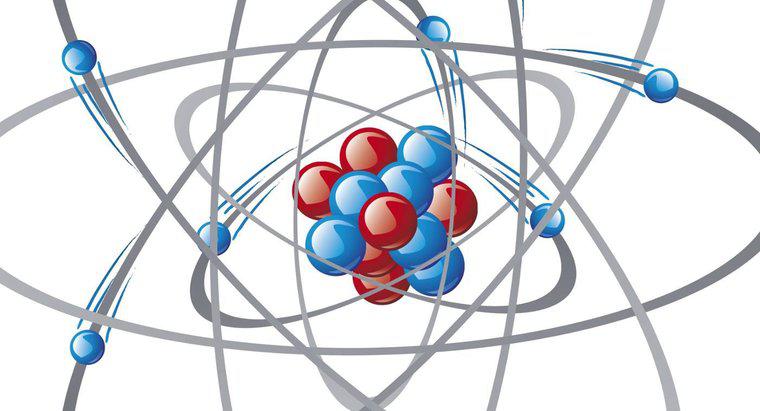
Les électrons d'un atome ne se trouvent pas dans le noyau avec les protons et les neutrons. Au lieu de cela, ils voyagent autour du noyau en orbitales. Ces orbitales sont également appelées coquilles énergétiques. Un élément est plus stable lorsqu'il a huit électrons dans sa couche d'énergie externe.
La règle de l'octet est un principe de chimie qui dit que les éléments perdent ou gagnent des électrons pour tenter de devenir plus stables. Les scientifiques disent qu'ils tentent d'atteindre la configuration de gaz noble ou de devenir davantage comme le gaz noble le plus proche du tableau périodique. Lorsque le chlore réagit avec d'autres éléments, par exemple, il tente d'atteindre la configuration électronique de l'argon.
Parce que le chlore n'a besoin que d'un électron de plus pour atteindre la configuration de gaz noble, c'est un élément très réactif. Il est possible qu'un atome de chlore gagne deux électrons, mais il faudrait de l'énergie supplémentaire pour capter le deuxième électron. Le Dr Anne Marie Helmenstine dit que le chlore est plus susceptible de participer à des réactions où il gagne un électron.