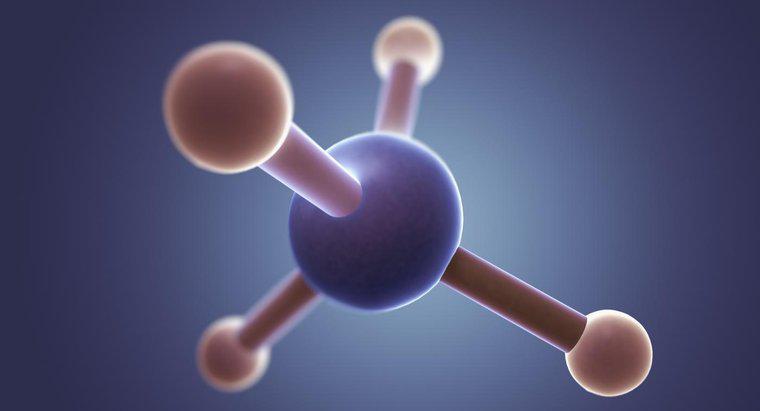
SiCl4 est du tétrachlorure de silicium, qui est une molécule non polaire. Le tétrachlorure de silicium est non polaire car les quatre liaisons chimiques entre le silicium et le chlore sont également réparties. La répartition uniforme des liaisons polaires donne une molécule qui n'a pas de pôles distincts.
Le tétrachlorure de silicium est un liquide à température ambiante et à pression atmosphérique normale, mais suffisamment volatil pour produire des fumées. Il n'est pas soluble dans l'eau et réagit pour former du dioxyde de silicium et de l'acide chlorhydrique lorsqu'il est mélangé avec de l'eau. Le tétrachlorure de silicium est soluble dans le benzène, le chloroforme, l'éther et l'acide chlorhydrique. Il est le plus souvent utilisé pour purifier le silicium élémentaire utilisé dans les micropuces et autres applications informatiques.