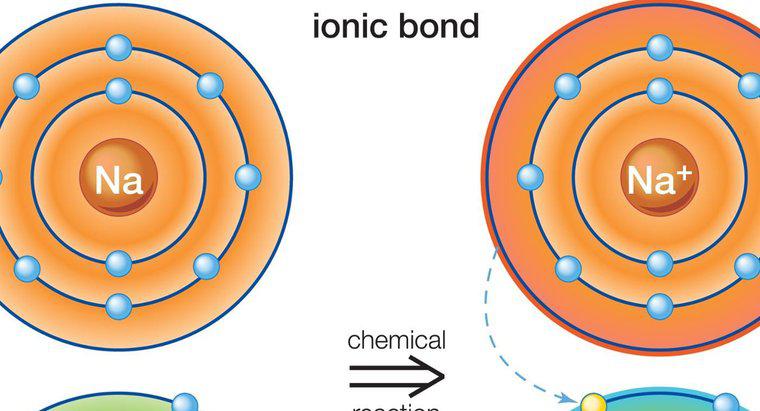
La dénomination des composés ioniques nécessite une identification correcte des espèces cationiques et anioniques présentes. Dans certains cas, la charge de l'ion est importante pour une dénomination précise.
Les principes de dénomination de la chimie standard identifient le cation en premier dans le nom et l'anion en second. Dans les composés ioniques, le cation est généralement un métal et la première partie du nom du composé est simplement ce métal. Si le cation peut exister naturellement dans plusieurs états chargés, la charge du métal, également connue sous le nom de valence, doit être identifiée dans le nom du composé avec des chiffres romains. Par exemple, le fer peut exister dans l'état positif à deux ou positif à trois charges. Ceux-ci seraient nommés fer (II) et fer (III), respectivement.
La dernière étape pour nommer un composé ionique consiste à identifier correctement l'anion présent. Les anions peuvent être un seul ion, comme le bromure, ou des molécules complexes composées de plusieurs atomes, comme le sulfate. Pour ces anions complexes, des paramètres de nommage supplémentaires sont en place. Les éléments capables de former plusieurs oxyanions, tels que l'azote et le soufre, ont une terminaison -ite ou -ate, selon le nombre de molécules d'oxygène présentes. Un exemple de composé ionique correctement nommé est le sulfate de fer (II) pour la formule ionique Fe(SO4).