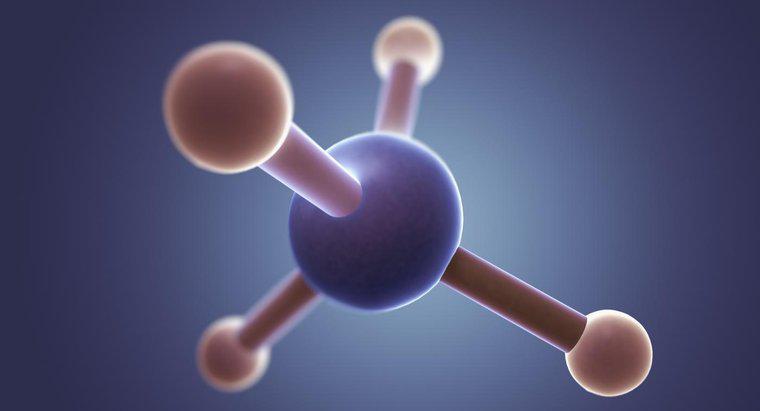
La structure de points de Lewis pour CH2F2, la formule chimique du difluorométhane, est un C au centre avec des lignes de chaque côté des deux H et des deux F. Chaque H contient 3 paires de points autour des côtés non liés.
Dans la structure de Lewis, le C représente le carbone, le H représente les deux atomes d'hydrogène, le F représente les deux atomes de fluor, les points représentent les électrons et les lignes représentent une paire d'électrons liés. Chaque atome de fluor contient sept électrons de valence. Ce nombre peut être déterminé par la colonne du fluor sur le tableau périodique. Chaque atome de carbone a quatre électrons, également indiqués par sa colonne dans le tableau périodique. Pour se lier avec deux atomes de fluor, l'atome de carbone doit créer une liaison unique avec chaque atome de fluor, en utilisant ses électrons de valence. L'un des sept électrons de valence des atomes de fluor se lie à l'électron unique de l'atome de carbone, laissant à chaque atome de fluor six électrons de valence non liés restants. Dans la structure de points de Lewis, ces électrons restants sont représentés par des points placés également autour du symbole des éléments. Pour vérifier l'exactitude de la structure de points de Lewis, les élèves peuvent compter tous les électrons, en comptant chaque point comme un électron et chaque liaison comme deux électrons. Le nombre d'électrons dans la structure doit être égal au nombre d'électrons dans CH2F2.