Les composés ioniques et moléculaires diffèrent principalement par la manière dont ils se forment. Les composés ioniques se forment par transfert d'électrons, tandis que les composés moléculaires se forment à la suite du partage d'électrons.
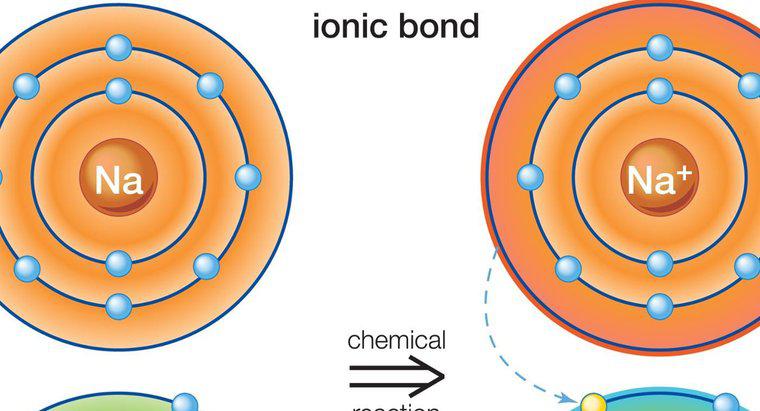
Les composés ioniques contiennent des atomes et des molécules avec des charges opposées. Ils se lient en raison de leurs charges opposées. Par exemple, un ion apparié négativement se lie à un ion positif. Les atomes et les molécules ayant des charges similaires se repoussent. Les molécules avec une charge positive sont appelées cations et les molécules avec une charge négative sont appelées anions.
Composés ioniques
Les composés ioniques se forment à la suite d'atomes ou de molécules attirant plus d'atomes ou de molécules avec une charge opposée. La composition varie selon le type de composé, mais tous les composés ioniques doivent avoir une charge électrique neutre. Cela signifie qu'ils doivent avoir un rapport égal de molécules anioniques et cationiques.
Les composés ioniques sont généralement solides. Ils peuvent être constitués d'atomes uniques, appelés composés monoatomiques, ou d'atomes multiples, ce qui en fait des composés polyatomiques. La liaison ionique, qui forme des molécules ioniques, implique le transfert d'électrons des métaux aux non-métaux. Les métaux ont tendance à perdre facilement des électrons positifs car ils ont peu d'électrons dans leur niveau d'énergie externe. Les non-métaux ont plus d'électrons négatifs dans leur niveau d'énergie externe. En conséquence, ils recherchent des ions positifs et se lient naturellement aux molécules métalliques. La plupart des composés polyatomiques sont anioniques, à l'exception du cation ammonium. Les composés ioniques diffèrent des composés moléculaires en ce qu'ils peuvent se former à partir de métaux et de non-métaux, tandis que les composés moléculaires ne peuvent se former qu'à partir de non-métaux. Les types courants de composés ioniques sont le sel et le sucre.
Composés moléculaires
Les composés moléculaires, également appelés composés covalents, partagent des électrons en formant des liaisons covalentes. Alors que les composés ioniques peuvent être constitués d'atomes et de molécules métalliques et non métalliques, des liaisons covalentes ne peuvent se former qu'à partir d'atomes et de molécules non métalliques. Un composé covalent se forme lorsque des atomes de différents éléments sont combinés par des molécules. Cette liaison permet le partage des électrons de valence, ce qui crée une attraction commune qui maintient ensemble les atomes de la molécule.
Les composés covalents varient considérablement en taille. Certains sont petits, avec seulement quelques éléments, tandis que d'autres peuvent avoir des milliers d'atomes. Parce qu'ils partagent des électrons au lieu de les échanger, les composés covalents ont des propriétés considérablement différentes de celles des composés ioniques. Les composés covalents ont tendance à brûler facilement, contrairement aux composés ioniques. Contrairement aux composés ioniques, ils ne sont pas solubles dans l'eau. Une autre distinction entre les deux types de molécules est que les composés covalents ne peuvent pas conduire l'électricité, mais les composés ioniques le peuvent généralement. À température ambiante, la plupart des composés covalents sont sous forme liquide ou gazeuse au lieu d'apparaître sous forme de solides. Cela est dû au fait que leurs molécules individuelles sont plus facilement séparées que les molécules d'un cristal, ce qui leur donne un point d'ébullition relativement bas. Les composés moléculaires simples ont la même structure de nom. Ils se trouvent sur le tableau périodique en nommant d'abord l'élément qui apparaît le plus à gauche sur le tableau, puis en ajoutant "ide" au deuxième élément nommé et en utilisant des préfixes pour identifier le nombre d'atomes dans chaque élément. Les protéines et les glucides sont deux exemples de composés moléculaires. D'autres composés moléculaires comprennent le méthane, l'oxyde d'azote et le chlorure de sodium.