La forme d'une protéine est déterminée par les quatre niveaux de structure de la protéine : primaire, secondaire, tertiaire et quaternaire. D'autres protéines chaperons sont présentes dans la cellule et assurent qu'une protéine se replie dans son forme appropriée.
Les protéines sont composées de polypeptides dans lesquels une séquence d'acides aminés est reliée par des liaisons peptidiques. Cette séquence est appelée structure primaire de protéines. La structure primaire est le plus souvent signalée par des abréviations d'une lettre ou de trois lettres pour les acides aminés, répertoriés en commençant par le côté N-terminal. La structure secondaire est un segment régulièrement replié d'une protéine formé par des liaisons hydrogène entre les atomes du squelette des acides aminés. Les deux principaux types de structure secondaire sont les hélices alpha et les feuillets bêta. Une hélice alpha contient 3,6 acides aminés par tour d'hélice. L'acide aminé proline ne rentre pas dans une hélice en raison de sa structure rigide. Les feuilles bêta contiennent des chaînes de liaisons peptidiques qui s'alignent les unes à côté des autres. Ils peuvent être soit parallèles, dans lesquels les deux brins s'alignent dans le sens, soit antiparallèles, dans lesquels chaque feuille est dirigée de manière opposée.
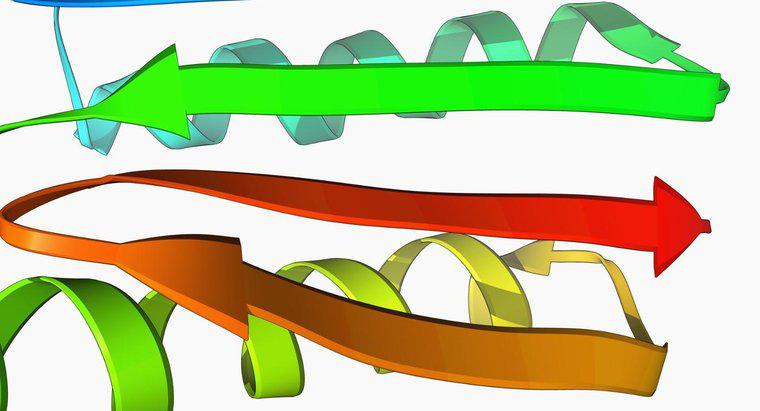
La structure tertiaire est la structure tridimensionnelle de l'ensemble de la chaîne peptidique. Dans les diagrammes de protéines, les hélices alpha sont généralement représentées sous forme de bobines et les feuilles bêta sont représentées sous forme de ruban plat. La structure tertiaire est maintenue par les interactions des chaînes latérales d'acides aminés telles que déterminées par leurs caractéristiques. La structure quaternaire est présente dans les protéines qui contiennent plus d'une chaîne polypeptidique, appelée domaine. C'est la disposition spatiale des domaines.