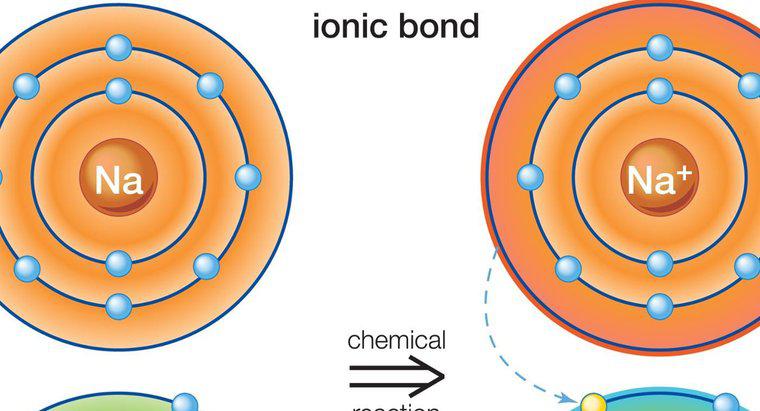
Les solutions aqueuses de composés ioniques sont de bons conducteurs d'électricité alors que les solutions de composés moléculaires ne le sont pas. Cela est vrai parce que les ions individuels des composés ioniques peuvent se dissocier complètement dans l'eau, les molécules restant entières. Les composés ioniques et moléculaires affectent également les points d'ébullition et de fusion de l'eau.
Les composés ioniques se dissolvent plus facilement dans l'eau que les composés moléculaires, bien qu'il existe des exceptions à cette règle. L'eau est utilisée comme norme pour déterminer la solubilité d'un composé car elle est très polaire et peut dissoudre plus de composés que tout autre solvant, ce qui lui donne le titre de solvant universel. Les composés ioniques conduisent l'électricité lorsqu'ils se dissocient car ils facilitent le transfert des électrons. La différence de charge des particules permet aux électrons libres de sauter facilement d'une particule à l'autre. Les molécules partagent leurs électrons et ont une charge globale neutre qui ne permet pas une grande conductivité.
Les composés ioniques ont des points de fusion et d'ébullition élevés, tandis que les composés moléculaires ont des points de fusion et d'ébullition relativement bas. Ces propriétés sont transférées à l'eau lorsque les composés s'y dissolvent. Les composés ioniques dissociés élèvent le point de fusion et abaissent le point de congélation de l'eau. Les composés moléculaires ont généralement l'effet inverse s'ils se dissolvent dans l'eau.