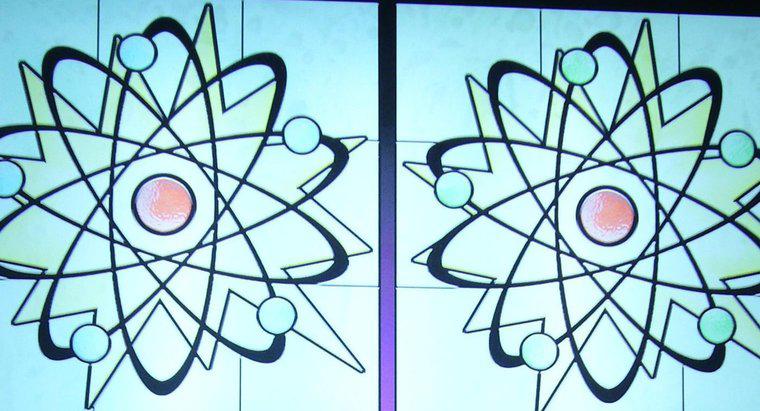
Le numéro atomique d'un atome est le nombre de protons qui résident dans le noyau, tandis que le nombre de masse est le nombre de protons et de neutrons combinés. Le numéro atomique détermine le type d'élément d'un atome , tandis que le nombre de neutrons détermine l'isotope de l'élément. De nombreux éléments se présentent naturellement sous la forme de plusieurs isotopes différents.
Tous les atomes ont un noyau, composé d'un amas de protons et de neutrons, ainsi qu'un « nuage » d'électrons qui entoure le noyau. Les protons sont des particules chargées positivement, les neutrons sont des particules qui n'ont pas de charge et les électrons sont des particules qui ont une charge négative.
Dans la plupart des cas, la charge nette d'un atome est neutre car les protons et les neutrons se trouvent en quantités identiques. Lorsqu'un atome gagne ou perd un électron, l'atome devient un ion chargé. Si un électron est perdu, l'atome se charge alors positivement ; cependant, s'il gagne un électron, l'atome devient chargé négativement.
Si un atome perd un neutron et devient un isotope, ses propriétés peuvent différer de celles de sa configuration naturelle. Souvent, les atomes radioactifs subissent un processus de désintégration qui entraîne la perte de neutrons de l'atome.