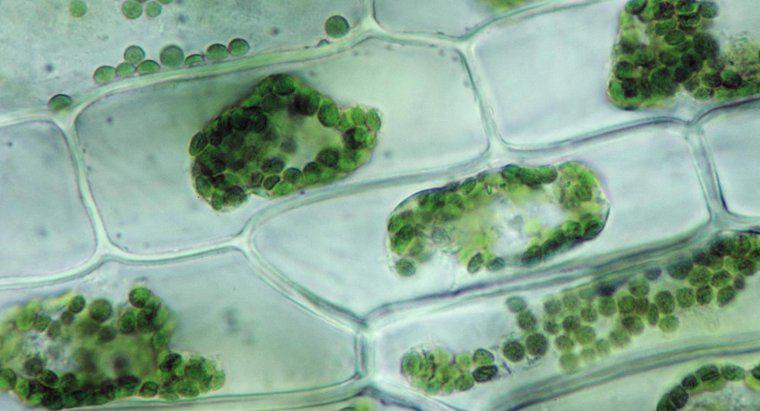
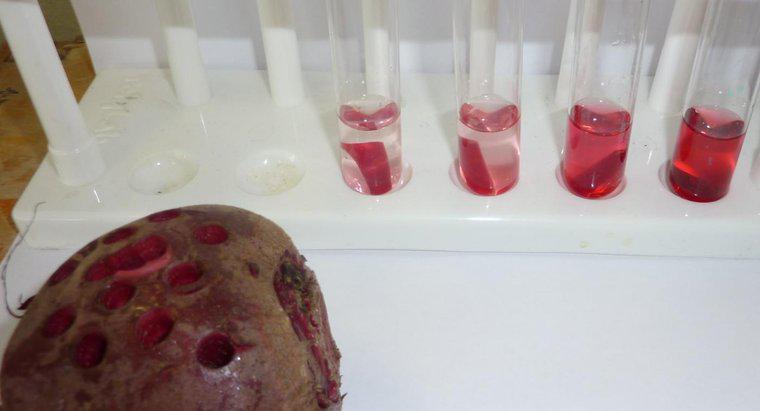
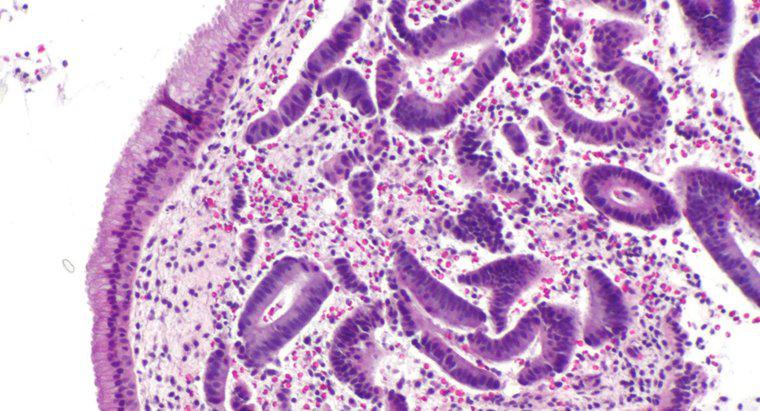
L'osmose est un type particulier de diffusion dans lequel l'eau traverse une membrane semi-perméable vers une zone avec une plus grande concentration de soluté, alors que la diffusion standard permet souvent le libre mouvement des solutés et du solvant vers l'équilibre. La diffusion en général est le mouvement net des molécules en solution des zones de concentration plus élevée vers les zones de concentration plus faible. La pression osmotique est potentiellement très puissante, la pression osmotique étant la seule force nécessaire pour déplacer l'eau des racines vers la cime des arbres les plus hauts du monde.
Lorsque l'eau dissout une autre substance, c'est parce que les molécules d'eau polaires et le soluté s'attirent. Chaque atome, ion ou molécule de soluté a une charge dans au moins une région qui attire un côté ou l'autre de la molécule d'eau. Ainsi, autant de molécules d'eau que possible ont tendance à se rassembler autour de chaque particule de solvant. Dans l'eau liquide, toutes les molécules sont en mouvement constant et aléatoire les unes autour des autres. Cependant, en raison de l'attraction, les molécules d'eau sont légèrement plus susceptibles de se déplacer vers les particules de soluté qu'elles ne s'en éloignent, et les particules de soluté sont plus susceptibles de se déplacer vers les molécules d'eau que les autres particules de solvant. Ce mouvement net se traduit, progressivement, par une répartition uniforme du soluté. En osmose, seules les molécules d'eau peuvent se déplacer pour égaliser les concentrations.