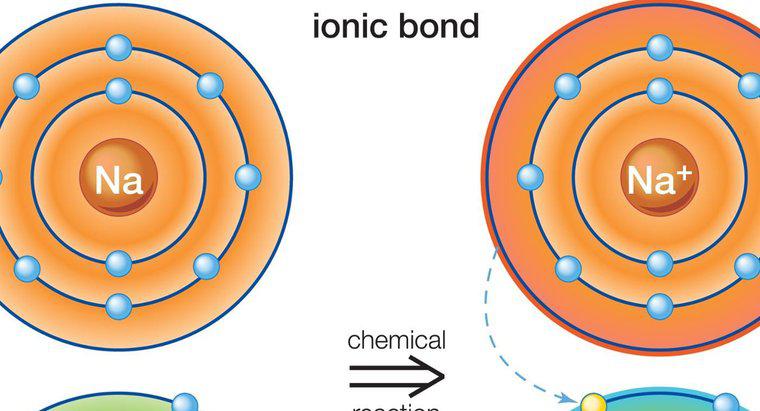
Le type de liaison que l'on trouve dans le chlorure de sodium est appelé liaison ionique. La liaison ionique est l'attraction entre deux atomes de charges opposées. Dans le chlorure de sodium, le sodium a une charge positive et le chlore a une charge négative ; par conséquent, ils s'attirent et forment un lien.
Le sodium et le chlore, en tant qu'atomes neutres, ne sont pas stables. Le sodium contient un électron de valence et le chlore en a sept. La règle de l'octet stipule que les atomes veulent avoir une enveloppe d'énergie externe comme celle des gaz rares, ce qui signifie qu'ils ont besoin de huit électrons de valence. Ces huit électrons du niveau d'énergie le plus externe représentent la stabilité. Ni le sodium ni le chlore n'ont cette structure de gaz noble, ils ont donc tendance à perdre ou à gagner des électrons pour atteindre un état plus stable. Le sodium perd son électron de valence unique au profit du chlore et devient un cation, un atome chargé positivement. Le chlore gagne un électron et devient un anion, un atome chargé négativement. Ces deux ions de charges opposées se réunissent pour former une liaison ionique.