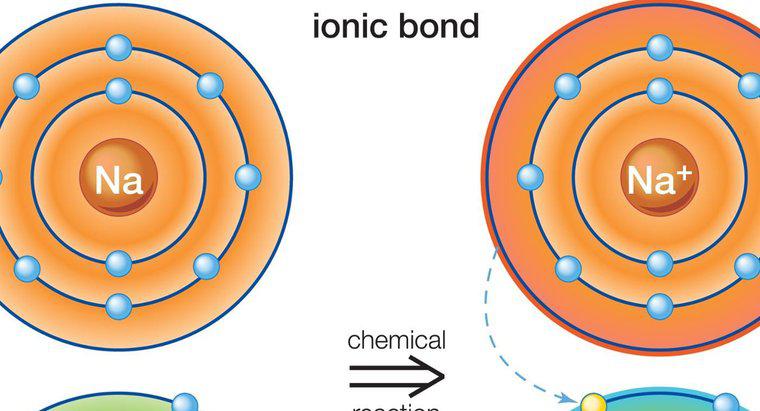
Une liaison ionique est un type de liaison chimique établie entre deux atomes par le transfert des électrons de valence d'un atome à un autre. Ce type de liaison est également connu sous le nom de liaison électrovalente ou polaire. Les sels sont un bon exemple de substances fabriquées avec une liaison ionique.
Une liaison ionique implique un atome métallique et un atome non métallique. Chaque atome a tendance à atteindre la configuration électronique stable, ce qui signifie atteindre le nombre d'octets (2 ou 8) de sa cantonnière. L'atome de métal a un excès d'électrons au-dessus du nombre d'octets dans sa coquille de cantonnière. D'autre part, l'atome non métallique manque d'électrons et a donc besoin d'électrons pour remplir son octet. Une fois qu'ils se rejoignent, l'atome métallique cède ses électrons excédentaires à l'atome non métallique. À la suite de ce transfert d'électrons, chacun des atomes atteint la configuration électronique stable. Le composé est formé par cette liaison appelée composé ionique ou électrovalent. Dans les liaisons ioniques, la charge nette du composé doit être nulle. Quelques exemples de composés ioniques sont : NaCl (chlorure de sodium), MgO (oxyde de magnésium), CaF2 (fluorure de calcium) et Al2O2 (oxyde d'aluminium). Dans le monde réel, on ne connaît pas l'existence de composés avec une liaison ionique pure. Tous les composés ioniques ont un degré de liaison covalente.