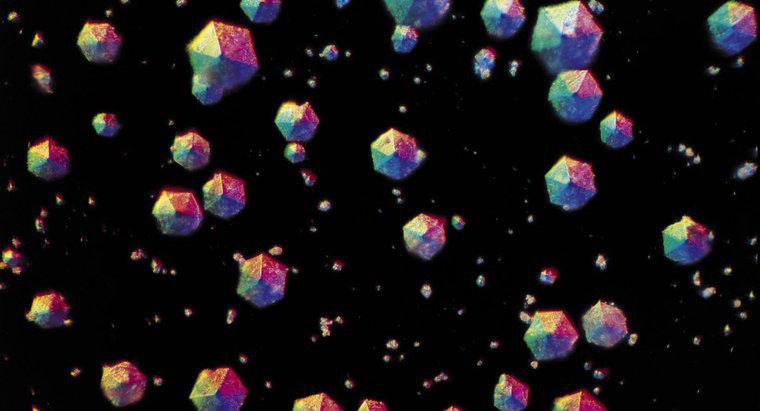La cristallisation sépare un solide dissous dans un liquide qui a formé une solution. Pour cristalliser le solide, la solution est chauffée dans un récipient ouvert pour permettre au liquide de s'évaporer, laissant le solide cristallin derrière.
La cristallisation peut être induite naturellement ou artificiellement. En plus des cristaux qui précipitent à partir d'une solution liquide, la cristallisation peut également se produire dans un liquide fondu qui est refroidi ou un gaz qui se dépose sur une surface. La cristallisation se déroule en deux étapes principales : la nucléation et la croissance cristalline.
Au cours de la phase de nucléation, les molécules de solvant dispersées dans la solution sont attirées les unes vers les autres, formant des amas de taille nanométrique. Arrêter le processus à ce stade et stabiliser les nanoclusters est une technique couramment utilisée dans la synthèse de nanoparticules. Laisser le processus se poursuivre donne des noyaux stables qui persistent sans se dissoudre dans la solution. La taille critique que ces noyaux doivent atteindre pour devenir stables dépend des conditions du système telles que la température de la solution et la concentration en solvant.
L'étape de croissance cristalline implique l'attraction ultérieure de molécules de solvant supplémentaires vers les noyaux qui ont précédemment réussi à atteindre une taille critique. Ce processus se poursuit tant que la solution est sursaturée : avoir plus de solvant dissous qu'il ne peut en supporter dans ces conditions particulières.