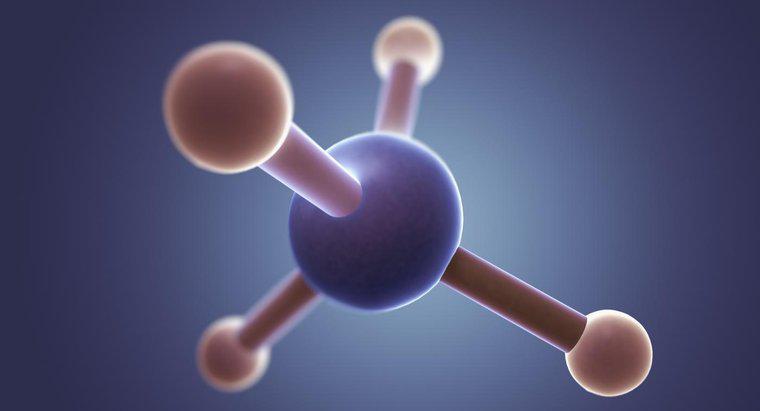
CH4, ou méthane, est une molécule non polaire. Le méthane est une molécule hautement symétrique composée d'atomes avec des électonégativités similaires, et par conséquent, il a un nuage d'électrons uniformément réparti et aucune région de charge significative .
Les molécules polaires contiennent des régions localisées de charges positives et négatives. La polarité résulte de la répartition inégale du nuage d'électrons moléculaires. Les électrons deviennent inégalement répartis lorsque les atomes au sein de la molécule ont des valeurs d'électronégativité très différentes. L'asymétrie moléculaire peut également contribuer à la polarité. Les atomes de carbone et d'hydrogène du méthane partagent les électrons dans leurs liaisons presque également, ce qui n'entraîne qu'un léger différentiel de charge entre les atomes de carbone et d'hydrogène. La géométrie tétraédrique symétrique du méthane contribue également à son manque de polarité.