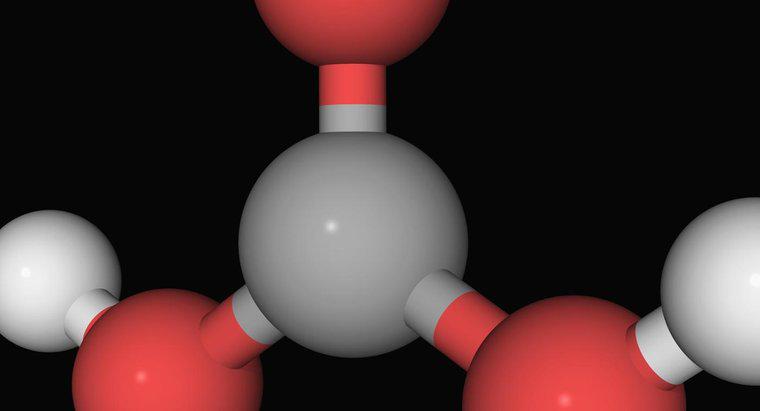
L'ammoniac, un composé gazeux d'un atome d'azote lié à trois atomes d'hydrogène, n'est pas une base forte. C'est une base plus faible qui doit généralement réagir avec l'eau avant de réagir avec un acide. Avant de neutraliser les acides dans une solution, il réagit avec l'eau pour former des ions ammonium et hydroxyde. L'ammonium est un ion positif d'un atome d'azote et de quatre atomes d'hydrogène, et c'est un acide faible.
Toutes les bases fonctionnent en acceptant des ions hydrogène, qui ne sont que des protons nus. Cela neutralise les acides, car les acides agissent en libérant des ions hydrogène pour réagir avec d'autres matériaux. Les bases réagissent avec ces ions plus puissamment que d'autres matériaux, et elles peuvent donc protéger ces autres matériaux des acides. Cependant, les bases elles-mêmes peuvent être corrosives.
Les bases les plus fortes, comme l'hydroxyde de sodium, agissent en dissociant leurs ions hydroxyde en solution. Les ions hydroxyde réagissent très fortement avec les ions hydrogène pour former de l'eau. Les autres composants des acides et des bases s'associent souvent sous forme de sels. Cependant, l'ammoniac ne contient pas d'ions hydroxyde. Il doit d'abord réagir avec l'eau pour les générer. Non seulement cela ajoute une étape avant de neutraliser les acides, mais cela est partiellement contrecarré par la création d'ammonium, un acide plus faible.