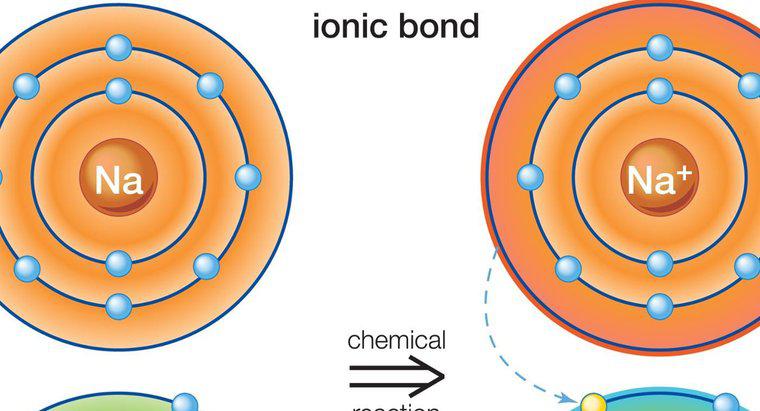
Les atomes plus gros avec des orbitales électroniques complexes, tels que ceux trouvés dans les métaux de transition, sont capables de dépasser la règle de l'octet dans les bonnes conditions. En particulier, ceux-ci se produisent lorsque les éléments les plus lourds sont liés à petits éléments hautement électronégatifs comme le fluor, le chlore ou l'oxygène. Un exemple est le pentachlorure de phosphore, un seul atome de phosphore lié à cinq atomes de chlore, qui a 10 électrons partagés dans sa couche de valence externe.
Lorsqu'un élément a un numéro atomique suffisamment élevé, un nouveau type d'orbitale électronique est disponible avec une capacité allant jusqu'à 10 électrons, permettant jusqu'à cinq liaisons simples. C'est ce qui se passe avec le pentachlorure de phosphore. Pour utiliser cette orbitale, cependant, la réaction créant le composé qui utilise cette orbitale doit être très énergétiquement favorable. C'est pourquoi, pour le faire fonctionner, des éléments ayant une très forte capacité d'attraction et de liaison des électrons, également appelés électronégativité, doivent être impliqués. L'oxygène a une électronégativité élevée, mais il est peu probable qu'il crée un composé avec cinq atomes liés comme le chlore, car il a besoin de deux électrons pour compléter sa couche de valence externe. Le fluor et le chlore n'en nécessitent chacun qu'un, et rendent donc ce type de configuration plus probable.