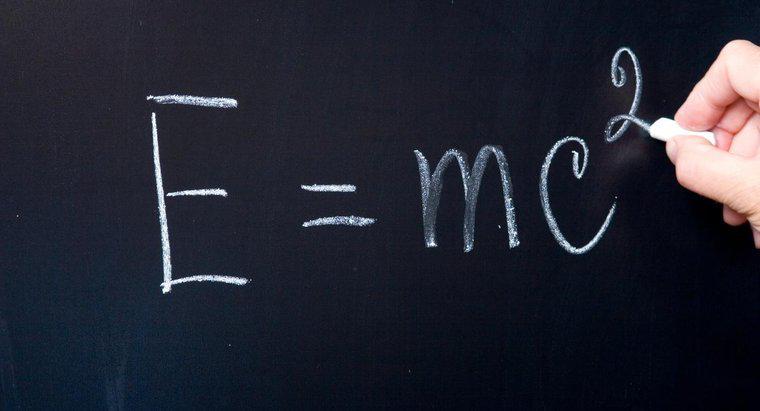Un saut d'électrons d'un niveau d'énergie le plus externe au niveau le plus interne ou au niveau du sol émettrait le photon de fréquence la plus élevée. Une baisse plus importante des niveaux d'énergie entraîne une fréquence plus élevée du photon émis.
Un atome d'hydrogène devient ionisé lorsque ses électrons ont suffisamment d'énergie pour sauter hors du niveau d'énergie le plus externe et se libérer de l'atome. Un électron près de s'échapper de l'atome a le plus d'énergie et émet donc un photon de haute énergie s'il descend jusqu'au niveau un. Si le photon contient plus d'énergie, il a une fréquence plus élevée. De plus, les niveaux d'énergie inférieurs sont plus éloignés que les niveaux supérieurs. Cela signifie que plus d'énergie est émise dans une chute d'électrons du niveau deux au niveau un que dans une chute du niveau quatre au niveau trois, et ainsi de suite.