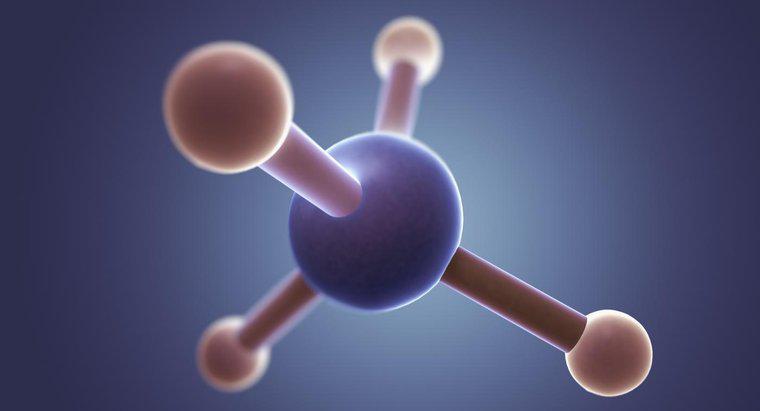
La structure de Lewis de CS2 consiste en un seul atome de carbone avec un atome de soufre de chaque côté. Les liaisons dans la structure de Lewis sont soit une double liaison reliant l'atome de carbone à chaque atome de soufre, soit un atome de soufre se connectant à une triple liaison et l'autre à une simple liaison.
Les structures de Lewis pour les molécules sont généralement écrites par essais et erreurs, à moins qu'elles ne soient déjà connues. La méthode pour déterminer une structure de Lewis nécessite que tous les électrons de valence soient pris en compte et que tous les atomes de la structure se retrouvent avec une couche complète d'électrons de valence.
Tout d'abord, connectez tous les atomes en utilisant l'électronégativité des éléments pour déterminer quels atomes vont où. Typiquement, si vous avez un atome de carbone et plusieurs autres atomes, l'atome de carbone sera au centre. Dans le cas de CS2, l'atome de carbone est moins électronégatif et forme le centre.
Ensuite, déterminez combien d'électrons sont présents. Dans CS2, les atomes de soufre contribuent chacun à six électrons de valence et l'atome de carbone à quatre pour un total de seize. 24 électrons seraient nécessaires pour fournir aux trois atomes une couche de valence complète de 8 électrons. Cela signifie que la molécule CS2 doit avoir un total de 8 liaisons reliant les trois atomes.