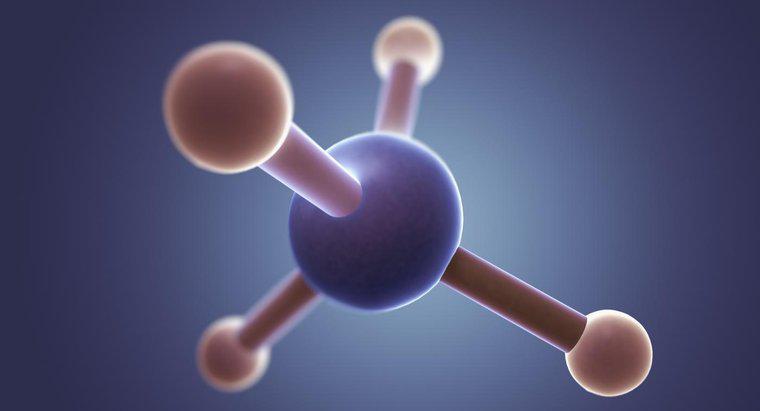
Le chlorure de méthyle (CH3Cl) a une forme tétraédrique avec un angle de liaison de 109,5 degrés. En effet, le carbone a quatre électrons de valence formant quatre liaisons et dans un espace tridimensionnel, une forme tétraédrique permet aux électrons liés d'être les plus éloignés les uns des autres.
Les formes moléculaires sont prédites à l'aide de la théorie de la répulsion des paires d'électrons de la couche de valence (VSEPR). Selon VSEPR, les molécules auront une forme géométrique qui permet à leurs centres de charge négative (électrons liés et à paires isolées) d'être aussi éloignés que possible les uns des autres, en raison de la répulsion mutuelle des charges négatives. Les molécules avec deux centres négatifs ont tendance à être linéaires (un angle de liaison de 180 degrés dans un plan bidimensionnel). Les molécules avec trois centres négatifs sont trigonales planaires (angles de liaison de 120 degrés dans un plan bidimensionnel) et les molécules avec quatre centres négatifs sont tétraédriques (angles de liaison de 108,5 degrés dans un espace tridimensionnel).
Le chlorure de méthyle a un atome de carbone central entouré de quatre liaisons simples (trois à l'hydrogène et une au chlore). Par conséquent, selon VSEPR, la molécule aura une forme tétraédrique avec un angle de liaison de 108,5 degrés pour permettre une séparation maximale des électrons liés.