La charge globale ou nette de tout composé ionique doit être égale à zéro. Bien que les ions eux-mêmes soient soit positifs (cation) soit négatifs (anion) par définition, la seule façon pour eux de se lier et de former un composé est en recherchant une charge opposée.
Un composé ionique en chimie fait référence à tout composé chimique dans lequel les ions sont maintenus ensemble, ou liés, par des liaisons ioniques. Les liaisons ioniques, par définition, sont des attractions électrostatiques entre deux ions de charge opposée. En d'autres termes, une liaison ionique ne peut se former qu'entre un cation et un anion.
Bien qu'il n'y ait pas de limite au nombre d'ions contenus dans un composé ionique, pour que le composé reste entier, la charge nette doit être égale à zéro. Par conséquent, il doit y avoir un nombre égal de cations et d'anions dans le composé terminé.
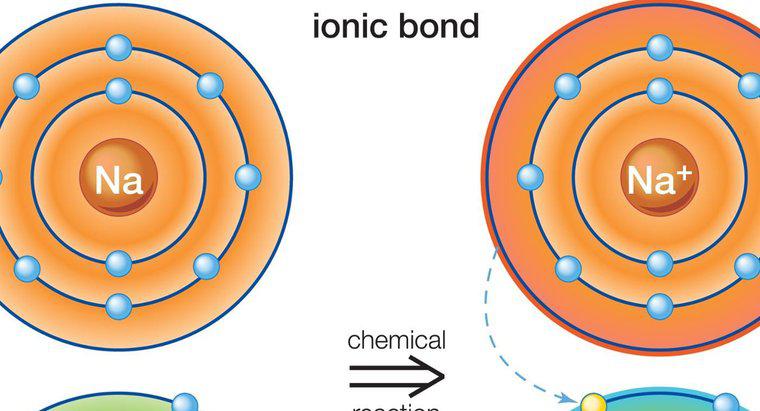
Un exemple populaire et commun d'un composé ionique qui affiche ce principe est le sel de table ou le chlorure de sodium, qui a la formule chimique NaCl. La formation de sel de table est le résultat d'une liaison ionique entre un cation sodium, Na+ et un anion chlore, Cl-. La structure de chaque ion est différente de celle d'un atome du même élément (Na ou Cl) qui détient une charge neutre en raison d'un nombre égal de protons et d'électrons. Ce n'est qu'une fois que chaque atome devient un ion qu'il est capable de se lier à l'autre atome et de créer un composé ionique.