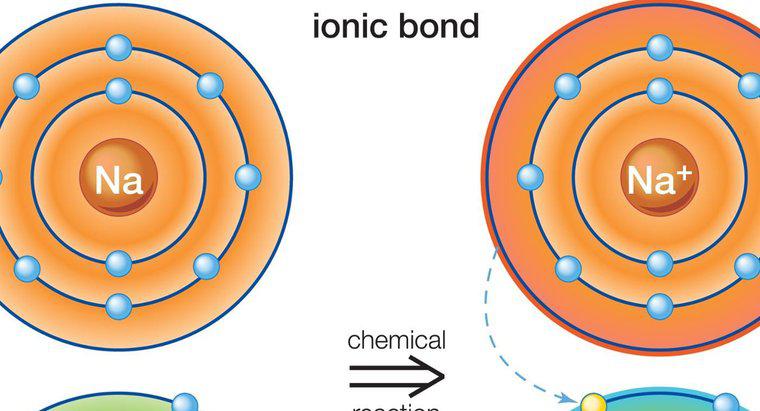
Les composés ioniques se forment lorsque les électrons passent d'un atome à un autre. Les composés covalents se forment lorsque les atomes partagent des électrons, ce qui n'entraîne aucune perte ou gain net d'électrons comme on le voit dans les composés ioniques.
Lorsque deux ou plusieurs éléments chimiques différents se combinent, ils forment un composé. La façon dont ces atomes se combinent ou se lient ensemble dépend de l'élément et de ses caractéristiques. La liaison qui maintient les atomes ensemble détermine le type de composé dont il s'agit, et ceux-ci peuvent être ioniques ou covalents.
Bases de la liaison Les atomes sont classés et caractérisés par le nombre d'électrons qu'ils contiennent. Chaque élément a un nombre différent d'électrons logés dans les orbitales qui tournent autour du noyau. L'orbitale externe est connue sous le nom d'orbitale de valence, et ces électrons sont ceux utilisés dans le processus de liaison. Chaque atome cherche à avoir une orbitale externe complète d'électrons afin d'être stable. Pour la plupart des atomes, cette orbitale externe contient huit électrons. La règle de l'octet fait référence à l'exigence des électrons de gagner, de perdre ou de partager des électrons afin de remplir l'orbitale externe. Lorsque les atomes gagnent ou donnent des électrons à un autre élément, ils forment des composés ioniques. Lorsque les atomes partagent des électrons avec un autre élément, ils forment des composés covalents.
Composés ioniques
Des composés ioniques se forment entre les métaux et les non-métaux. Les métaux ont généralement peu d'électrons de valence dans l'orbite externe, tandis que les non-métaux en ont beaucoup. Le métal agit comme un donneur et transfère ses électrons de valence au non-métal, satisfaisant ainsi la règle de l'octet nécessaire pour former un atome stable. Il en résulte un atome de métal chargé positivement et un atome non métallique chargé négativement, appelés ions. En raison des charges opposées, les deux ions sont attirés l'un vers l'autre et restent proches l'un de l'autre, formant ainsi un composé ionique. Plus d'un électron peut être transféré dans ce processus. Parce que les atomes chargés flottent librement, ils sont attirés par d'autres atomes de charge opposée, pas seulement par l'atome unique dont ils ont donné ou reçu des électrons.
Les caractéristiques des composés ioniques sont qu'ils sont des solides cristallins avec des points de fusion et d'ébullition élevés. Ils conduisent l'électricité lorsqu'ils sont fondus et sont solubles dans l'eau mais pas dans les liquides non polaires. L'un des composés ioniques les plus courants est le chlorure de sodium (NaCl), également connu sous le nom de sel de table.
Composés covalents
En revanche, les composés covalents se produisent généralement entre des non-métaux ou deux atomes d'éléments identiques ou similaires. Les atomes ayant des électronégativités similaires, qui peuvent être déterminées à partir du tableau périodique, ont tendance à s'attirer et à former des liaisons covalentes. Plutôt que de transférer complètement les électrons de valence, les atomes partagent les électrons externes pour satisfaire la règle de l'octet. Les électrons partagés peuvent aller et venir entre les atomes liés. Aucun atome ne gagne ou ne perd un électron dans ce type de liaison, donc aucun ion ne se forme. Pour cette raison, les atomes du composé ne sont pas attirés par d'autres atomes à proximité comme ceux observés dans les composés ioniques.
Les composés covalents peuvent être solides, liquides ou gazeux. Ils ont tendance à être de mauvais conducteurs électriques et ont des points de fusion et d'ébullition bas. Ils ont tendance à être solubles dans les liquides non polaires mais pas dans l'eau. Quelques exemples courants de composés covalents sont le méthane (CH4) et le dioxyde de carbone (CO2).