Les composés ioniques conduisent l'électricité lorsqu'ils sont dissous dans l'eau car le mouvement de leurs particules chargées négativement et positivement forme un courant électrique, explique About.com. Dans cet état liquide, les ions chargés se séparent et se déplacer librement, créant un courant de particules électriques qui conduisent l'électricité.
La conductivité électrique mesure la capacité d'une substance à produire un courant électrique, alors que l'électricité est le mouvement de particules chargées qui forment ce courant électrique. Un courant, dans le domaine électrique, est simplement un flux de charges qui nécessite une libre circulation. Pour que le courant électrique se forme, le mouvement et la conductivité doivent être présents.
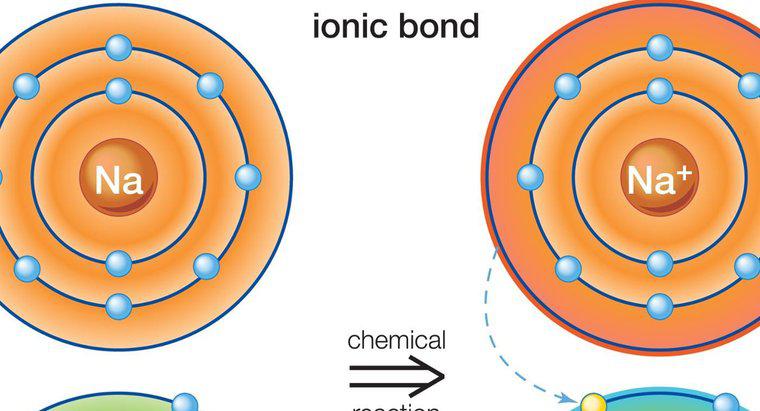
Les composés ioniques se forment lorsque des ions chargés positivement et négativement sont étroitement liés les uns aux autres. Ces ions sont des atomes qui ont gagné ou perdu un électron, et ils se réunissent en transférant un électron dans un processus appelé liaison ionique. Un ion chargé positivement est un cation, tandis qu'un ion chargé négativement est un anion. Un exemple de composé ionique est le chlorure de sodium, NaCl, dans lequel le sodium (NA) est le cation et le chlore (Cl) est l'anion.
Les composés ioniques à l'état solide ont des particules qui sont étroitement liées, limitant tout mouvement et empêchant la formation de courant électrique. Par conséquent, les solides ioniques ne conduisent pas l'électricité. Lorsqu'il est dissous dans l'eau, la liaison ionique est rompue, ce qui permet aux ions chargés d'être séparés et de circuler librement. L'eau assure le mouvement des particules et les ions séparés assurent la conductivité. Puisque les deux sont présents, un courant électrique est créé pour conduire l'électricité.