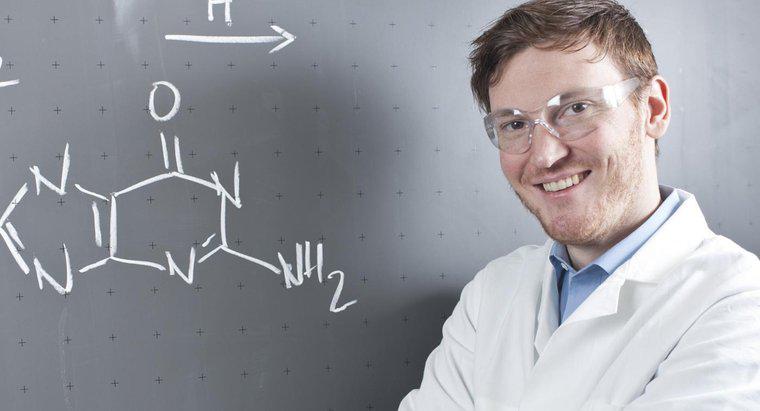
Une flèche qui pointe dans les deux sens dans une équation chimique montre que la réaction est réversible et peut se dérouler dans les deux sens. Cela signifie que les réactifs du côté gauche sont également les produits de ceux de droite et vice versa.
Il est incorrect d'écrire une réaction réversible sous la forme de deux équations chimiques distinctes (une pour chaque direction) car les produits réagissent toujours et redeviennent les réactifs d'origine. Parce que les deux réactions se produisent simultanément, le système chimique est dans un état de flux jusqu'à ce que l'équilibre soit atteint. Cela signifie qu'il existe un point où la concentration de chaque réactif reste constante et ne présente aucun changement net dans le temps. Cela ne signifie pas pour autant que chaque réactif est présent dans des proportions égales.
La vitesse de réaction et les coefficients de réaction de chaque réactif déterminent la quantité et la rapidité de production. Parce que certaines réactions sont plus rapides et nécessitent de plus grandes quantités d'un réactif qu'un autre, elles ne sont pas présentes en quantités égales lorsque le système atteint l'équilibre. Dans les systèmes d'équilibre dynamique, les taux de réaction des deux côtés de l'équation sont exactement les mêmes, de sorte que les concentrations des réactifs et des produits restent constantes même si les deux réactions continuent de se dérouler indéfiniment.