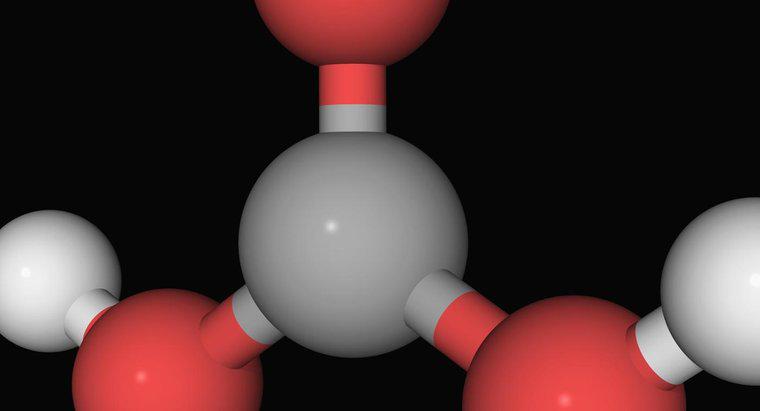
La neutralisation d'une substance acide est accomplie en la combinant avec une substance basique, ce qui entraîne la formation d'eau et d'un sel, explique UC Davis ChemWiki. La réaction de neutralisation se produit en raison de l'acide donnant des ions H+ tandis que la base donne des ions OH-.
Pour qu'une solution acide-base atteigne la neutralisation, la quantité, ou en moles, d'ions H+ doit être équivalente au nombre de moles d'ions OH-, note UC Davis ChemWiki. Ainsi, s'il y a quatre moles d'ions H+ dans l'acide, il se neutralise lorsqu'il est combiné avec la quantité nécessaire de base pour fournir quatre moles d'ions OH-.
Une fois que tous les ions H+ et OH- sont épuisés dans la réaction sans qu'il ne reste d'ions en excès, la réaction est dite à son point d'équivalence, explique UC Davis ChemWiKi. Si l'acide et la base dans la réaction sont tous deux forts, la solution résultante a un pH de sept. Si l'acide est fort alors que la base est faible, une solution avec un pH inférieur à sept se produit. Enfin, si l'acide est faible alors que la base est forte, la solution résultante a un pH supérieur à sept.
Les substances utilisées pour neutraliser les déversements chimiques sont généralement faibles car la réaction d'un acide fort et d'une base forte est violente, explique le responsable du laboratoire. Certains neutralisants contiennent des ingrédients qui provoquent un changement de couleur d'un déversement afin que les observateurs puissent savoir quand la neutralisation se produit.