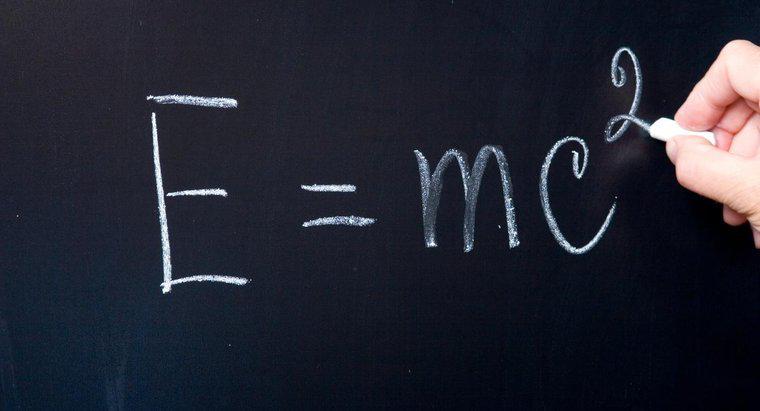Le "niveau d'énergie occupé le plus élevé" désigne le niveau d'énergie dans lequel résident les électrons de valence. Les éléments suivent la règle de l'octet, ce qui signifie qu'ils veulent atteindre l'arrangement stable d'avoir huit électrons dans leur plus haut niveau d'occupation. niveau d'énergie. Certains atomes veulent abandonner des électrons, et d'autres veulent gagner des électrons pour devenir plus stables.
Les électrons de Valence n'existent que dans les orbitales s et p du niveau d'énergie le plus élevé. Le principe d'Aufbau stipule que les électrons doivent d'abord remplir les niveaux d'énergie les plus bas avant de passer au niveau d'énergie suivant. Chaque niveau d'énergie a un nombre spécifique d'orbitales ; seuls deux électrons tournant dans des directions opposées peuvent remplir chaque orbitale. Les électrons existent à différentes distances du noyau de l'atome. Les électrons occupant des orbitales plus proches du noyau ont une énergie plus faible que ceux qui orbitent plus loin.
Les éléments les plus stables du tableau périodique, les gaz nobles, ont huit électrons à leur niveau d'énergie occupé le plus élevé ; les gaz rares ne forment pas facilement des composés avec d'autres éléments. Les électrons au niveau d'énergie occupé le plus élevé ont beaucoup à voir avec la réactivité de l'élément. Des éléments tels que les métaux avec peu d'électrons dans leurs niveaux d'énergie les plus élevés veulent les donner à d'autres éléments. Les éléments comme les non-métaux ont presque un complément complet de huit électrons dans leurs niveaux d'énergie les plus externes, ils veulent donc obtenir des électrons des éléments.