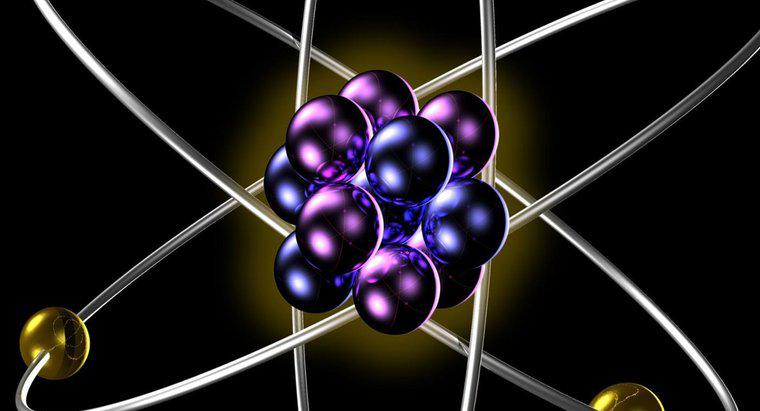
Les isotopes du même élément ont le même nombre de protons et d'électrons lorsqu'ils sont sous forme atomique neutre. Différents isotopes ont différents nombres de neutrons dans leurs noyaux, ce qui entraîne des poids atomiques différents pour les différents isotopes de un seul élément.
Le nombre de protons dans le noyau des atomes d'un élément donne la masse atomique de cet élément. La masse atomique est constante pour tous les isotopes de l'élément. Parce que la masse atomique détermine le nombre d'électrons qui doivent orbiter autour du noyau pour que l'atome soit neutre, cette masse atomique détermine le comportement chimique de l'élément, car toute la chimie non nucléaire résulte des interactions des nuages d'atomes d'électrons avec un un autre. Cela signifie que tous les isotopes d'un même élément participent de la même manière aux réactions chimiques.
Une différence de comportement isotopique apparaît lorsque les noyaux de certains isotopes sont instables en raison d'un déséquilibre du nombre de protons par rapport aux neutrons dans le noyau. Il devrait y avoir environ un neutron pour chaque proton pour qu'un noyau atomique soit stable. À mesure que le nombre de neutrons augmente de manière disproportionnée par rapport au nombre de protons, le noyau devient instable, se débarrassant de cet excès de poids de neutrons sous forme de particules alpha et bêta et de rayonnement gamma.